شیمی تجزیه
شیمی تجزیه به عنوان یک بخش کاربردی در علوم مختلف است هدف از این وبلاگ ارائه روشهای تجزیه ای پرکاربرد است. https://www.instagram.com/_u/ShimiGeramشیمی تجزیه
شیمی تجزیه به عنوان یک بخش کاربردی در علوم مختلف است هدف از این وبلاگ ارائه روشهای تجزیه ای پرکاربرد است. https://www.instagram.com/_u/ShimiGeramدرباره من
پیوندها
- پایگاه اطلاعات علمی جهاد دانشگاهی دسترسی به چکیده و متن کامل مقالات به صورت رایگان
- مرجع دانش نمایه کنفرانس های کشور
- پایگاه اطلاعات نشریات کشور بزرگترین مرجع و نمایشگاه دائمی مطبوعات کشور
- بانک مقالات فارسی
- کتابخانه کنگره آمریکا
- سایتی برای دستبابی به برخی از نرم افزارهای شیمی آموزش شیمی
- بفرمایید روحیه (ویولت) ویولت مبتلا به ام اس است و برای حرکت از ویلچر و واکر استفاده می کند. او می نویسد شرح ساده گذران زندگی اش را تا اثبات کند این جمله از فیلم طلا و مس را که "خوشبختی دیدن چیزهای کوچک است"
دستهها
ابر برجسب
جداسازی ارشد شیمی بودجه بندی سوالات فاز معکوس فاز نرمال قطبیت فاز متحرک انتخاب فاز متحرک HPLC کروماتوگرافی مایع با کارایی بالابرگهها
جدیدترین یادداشتها
همه- فصول طلایی شیمی تجزیه
- برگی از دفتر خاطرات
- انتخاب فاز متحرک در HPLC
- نماد شیمیایی عنصر ها از کجا آمدند؟
- در غیاب اینترنت بین الملل چه کنیم
- پاسخ به سوالات شما
- معرفی رشته شیمی کاربردی
- ساختار لوویس
- پیش تغلیظ و اندازه گیری مقادیر بسیار کم جیوه در نمونه های حقیقی
- مندلییف و عاشقی
- کجا دنبال مقاله بگردیم؟
- شیمی دارویی
- شیمی تجزیه در کنکور ارشد سالهای اخیر
- پاسخ تشریحی سوالات کنکور کارشناسی ارشد96- درس شیمی تجزیه
- پاسخ سوالات شیمی کنکور سراسری ریاضی 96
نویسندگان
بایگانی
- دی 1402 1
- اردیبهشت 1402 1
- دی 1401 1
- آبان 1401 1
- آبان 1398 2
- مرداد 1398 1
- مهر 1397 2
- تیر 1397 1
- اردیبهشت 1397 2
- آذر 1396 2
- تیر 1396 3
- اردیبهشت 1396 2
- فروردین 1396 2
- اسفند 1395 4
- دی 1395 1
- آذر 1395 2
- آبان 1395 3
- مهر 1395 2
- اسفند 1394 1
- بهمن 1394 1
- دی 1394 1
- آذر 1394 4
- آبان 1394 1
- مهر 1394 3
- شهریور 1394 5
- مرداد 1394 4
- تیر 1394 2
- خرداد 1394 5
- اردیبهشت 1394 15
- فروردین 1394 7
- اسفند 1393 7
- بهمن 1393 4
- دی 1393 12
- آذر 1393 14
- آبان 1393 7
- مهر 1393 16
- شهریور 1393 7
- مرداد 1393 2
- تیر 1393 4
- خرداد 1393 18
- اردیبهشت 1393 14
- فروردین 1393 2
- اسفند 1392 8
- بهمن 1392 4
- دی 1392 16
- آذر 1392 7
- آبان 1392 9
- مهر 1392 15
- شهریور 1392 12
- مرداد 1392 9
- تیر 1392 9
- خرداد 1392 28
- اردیبهشت 1392 33
- فروردین 1392 2
- اسفند 1391 23
- بهمن 1391 2
- دی 1391 4
تقویم
دی 1402| ش | ی | د | س | چ | پ | ج |
| 1 | ||||||
| 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 23 | 24 | 25 | 26 | 27 | 28 | 29 |
| 30 |
جستجو
پاسخ به سوالات دانشجویان در درس تجزیه دو و اصول تصفیه آب وپساب های صنعتی
سلام
این پست اختصاص دارد به سوالات دانشجویان در درس تجزیه II و نیز درس اصول تصفیه آب و پساب های صنعتی
هر چند که نتیجه تلخ ناداوری بازی دیشب دل و رمق را از ایشان ربوده!! اما بازی قهرمانانه یوزپلنگان ایرانی مقابل مدعی بزرگ قهرمانی جام جهانی و یکی از بهترین بازیکنان حال حاضر جهان باعث شگفتی تمامی محافل فوتبالی جهان و نیز ایشان!! شده است.
سوالات خود را در قسمت نظرات قرار دهید تا پاسخ آنرا در این قسمت ببینید.
یا علی
سوالات تجزیه دو با توزیع فراوانی اعلام شده قبلی از کتاب اسکوک و جزوه طرح شده است که به صورت کلی زیر بارم بندی شده است.
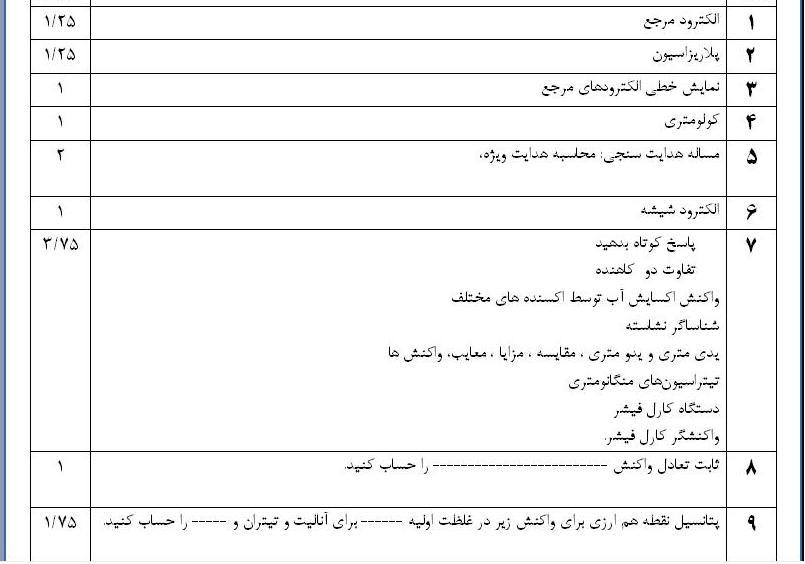
سلام استاد عزیز
برای فردا امتحان تجزیه٢ فقط باید همینارو بخونیم؟
پاسخ:
سلام دانشجوی گرامی
برای پاسخ به این 9 سوال باید مطالب جزوه و کتاب را که تعیین کردم مطالعه کنید.
راهنمایی انجام شده به شما کمک می کند در کدام قسمت ها تمرکز بیشتری داشته باشید.
واکنشهای کاهنده جونز و والدن

اکسایش آب توسط اکسنده های مختلف
به طور ویژه دو اکسنده پرمنگنات و دی کرومات را استفاده کنید و واکنش آنها را با آب از کتاب اسکوگ مطالعه نمایید.
تفاوت یدی متری و یدومتری
سلام
اکسایش آب توسط پرمنگنات و دی کرومات را از روی کتاب مطالعه کنید!
تفاوت یدومتری و یدومتری:
در یدی متری: آنیون تری یدید تیترانت بوده و نقش اکسنده را دارد و از این روش برای اندازه گیری گونه های کاهنده ای که مستقیما با ید اکسایش می یابند استفاده می شود و چون از ابتدا در محلول یون تری یدید وجود ندارد می توان از ابتدا شناساگر نشاسته را به آن اضافه کرد که رنگ محلول بی رنگ خواهد شد و نقطه پایانی با تغییر شناساگر به رنگ ابی مشخص می شود
یدومتری
برای اندازه گیری گونه های اکسنده بر اساس تیتراسیون برگشتی استفاده می شود در این روش ابتدا یون یدید توسط گونه به یون تری یدید اکسید می شود و سپس مقدار یون یدید تولید شده توسط تیتراسیون با تیوسولفات مشخص می شود. در این روش چون از ابتدا یون تری یدید در محلول موجود است نمی توان شناساگر نشاسته را از ابتدا به آن اضافه کرد.
شناساگر نشاسته را هنگامی که رنگ محلول از زرد پررنگ تر به سمت زرد کاهی پیشرفت داشت اضافه می کنند و در این حالت رنگ محلول آبی می شود. نقطه پایانی جایی است که رنگ آبی از بین می رود.
استاد دستگاه کارل فیشر نه تو جزوه بود نه کتاب!دقیقا منظور چیه؟
الکترود شیشه هم کتاب خیلی پراکنده و نامفهوم توضیح داده!
ممنون میشم توضیح بدین!
سلام
عیبی نداره ماهم خدایی داریم.
ولی اسناد اون روز ک نذاشتی پیشت بشینم خیلی ناراحت شدمولی بازم دوست دارم.
سلام
به این دلیل که
زیرا که
و به این علت که
من از عاشقا می ترسم
استادعاشقم
سلام یعنی تازه کشفش کردی
یعنی تازه کشفش کردی 
از اولشم معلوم بود آقای .... که عاشقی
یا علی
استاد میگم این پاسخ کوتاه ها چقد جواباش زیاده!!!
سلام
جواباش یک جمله است اگر سوالاتش کامل باشه!!!
درود بر استاد عزیز
استاد منگانومتری کجاست و چی میشه؟
سلام بر شما که ناشناس آمدی!!
منگانومتری به معنی تعیین غلظت پرمنگنات در محیط در یک واکنش اکسایش کاهش می باشد و یون پرمنگنات به عنوان اکسنده و تیترانت عمل می کند و تیتر شونده را اکسید می کند این روش نیاز به شناساگر ندارد زیرا
محلول پتاسیم پرمنگنات رنگ بنفش تندی دارد که بر اثر کاهش بی رنگ میشود.به همین دلیل در منگانومتری استفاده از معرفها ی نشان دهنده اتمام واکنش نیاز نیست،اتمام واکنش از روی ظاهر ویا محو شدن رنگ پر منگنات تشخیص داده میشود.
یون پرمنگنات در محلول اسیدی عامل اکسنده خوبی است و مناسب ترین اسید برای این کار اسید سولفوریک((H2SO4است زیرا محلول رقیق بر روی پرمنگنات اثری ندارد.
پرمنگنات پتاسیم اکسید کننده پر قدرتی است که شاید در بین تمام عوامل اکسید کننده استاندارد،بیشترین کاربرد را در شیمی داشته باشد،دسترسی آسان،قیمت ارزان،قدرت اکسندگی بالا و عدم نیاز به شناساگر در تیتراسیونها عواملی است که استفاده از این واکنشگر را گسترش داده است.این واکنشگر معایبی نیز دارد.از جمله این معایب میتوان به پایداری محدود محلول های استاندارد و وابستگی شدید توان اکسیدکنندگی آن به pH و محیط اشاره کرد.
سلام استاد،مرسی از لطفتون!
استاد دستگاه کارل فیشر نه تو جزوه بود نه کتاب!دقیقا منظور چیه؟
الکترود شیشه هم کتاب خیلی پراکنده و نامفهوم توضیح داده!
ممنون میشم توضیح بدین!
سلام
جزوه هدایت سنجی را از لینک زیر بگیرید!
http://s2.picofile.com/file/7602292903/jozveh.pdf.html
دستگاه کارفیشر هم داخل جزوه است هم داخل کتاب و نیز داخل این جزوه ای که دانلود می کنید.
الکترود شیشه اصلا هم پراکنده نیست
شکل الکترود
واکنش های الکترود
نحوه عمل آن که پتانسیل مرزی را به غلظت یون هیدرونیم ربط می دهد
تعداد الکترودهای مرجع بکار رفته در آن
هدف آن
انواع خطاهای اسیدی و قلیایی
به طور کامل در کتاب و نیز سرکلاس توضیح داده شده!
یا علی
سلام استاد شبتون بخیر واکنش اکسایش آب توسط اکسنده های مختلف چی میشه؟ و تفاوت یدومتری و یدیمتری در چیست؟
سلام
اکسایش آب توسط پرمنگنات و دی کرومات را از روی کتاب مطالعه کنید!
تفاوت یدومتری و یدومتری:
در یدی متری: آنیون تری یدید تیترانت بوده و نقش اکسنده را دارد و از این روش برای اندازه گیری گونه های کاهنده ای که مستقیما با ید اکسایش می یابند استفاده می شود و چون از ابتدا در محلول یون تری یدید وجود ندارد می توان از ابتدا شناساگر نشاسته را به آن اضافه کرد که رنگ محلول بی رنگ خواهد شد و نقطه پایانی با تغییر شناساگر به رنگ ابی مشخص می شود
یدومتری
برای اندازه گیری گونه های اکسنده بر اساس تیتراسیون برگشتی استفاده می شود در این روش ابتدا یون یدید توسط گونه به یون تری یدید اکسید می شود و سپس مقدار یون یدید تولید شده توسط تیتراسیون با تیوسولفات مشخص می شود. در این روش چون از ابتدا یون تری یدید در محلول موجود است نمی توان شناساگر نشاسته را از ابتدا به آن اضافه کرد.
شناساگر نشاسته را هنگامی که رنگ محلول از زرد پررنگ تر به سمت زرد کاهی پیشرفت داشت اضافه می کنند و در این حالت رنگ محلول آبی می شود. نقطه پایانی جایی است که رنگ آبی از بین می رود.
خیلی ممنون استاد از راهنمایی و لطفتون
ببخشید اما "تفاوت دو کاهنده" درچیست؟
سلام
تفاوت دو کاهنده جونز و والدن
طرز عمل هریک و واکنش دهنده های آنها باید مقایسه کنید
یا علی
سلام استاد عزیز
برای فردا امتحان تجزیه٢ فقط باید همینارو بخونیم؟
سلام دانشجوی گرامی
برای پاسخ به این 9 سوال باید مطالب جزوه و کتاب را که تعیین کردم مطالعه کنید.
راهنمایی انجام شده به شما کمک می کند در کدام قسمت ها تمرکز بیشتری داشته باشید.
یا علی