شیمی تجزیه
شیمی تجزیه به عنوان یک بخش کاربردی در علوم مختلف است هدف از این وبلاگ ارائه روشهای تجزیه ای پرکاربرد است. https://www.instagram.com/_u/ShimiGeramشیمی تجزیه
شیمی تجزیه به عنوان یک بخش کاربردی در علوم مختلف است هدف از این وبلاگ ارائه روشهای تجزیه ای پرکاربرد است. https://www.instagram.com/_u/ShimiGeramدرباره من
پیوندها
- پایگاه اطلاعات علمی جهاد دانشگاهی دسترسی به چکیده و متن کامل مقالات به صورت رایگان
- مرجع دانش نمایه کنفرانس های کشور
- پایگاه اطلاعات نشریات کشور بزرگترین مرجع و نمایشگاه دائمی مطبوعات کشور
- بانک مقالات فارسی
- کتابخانه کنگره آمریکا
- سایتی برای دستبابی به برخی از نرم افزارهای شیمی آموزش شیمی
- بفرمایید روحیه (ویولت) ویولت مبتلا به ام اس است و برای حرکت از ویلچر و واکر استفاده می کند. او می نویسد شرح ساده گذران زندگی اش را تا اثبات کند این جمله از فیلم طلا و مس را که "خوشبختی دیدن چیزهای کوچک است"
دستهها
ابر برجسب
جداسازی ارشد شیمی بودجه بندی سوالات فاز معکوس فاز نرمال قطبیت فاز متحرک انتخاب فاز متحرک HPLC کروماتوگرافی مایع با کارایی بالابرگهها
جدیدترین یادداشتها
همه- فصول طلایی شیمی تجزیه
- برگی از دفتر خاطرات
- انتخاب فاز متحرک در HPLC
- نماد شیمیایی عنصر ها از کجا آمدند؟
- در غیاب اینترنت بین الملل چه کنیم
- پاسخ به سوالات شما
- معرفی رشته شیمی کاربردی
- ساختار لوویس
- پیش تغلیظ و اندازه گیری مقادیر بسیار کم جیوه در نمونه های حقیقی
- مندلییف و عاشقی
- کجا دنبال مقاله بگردیم؟
- شیمی دارویی
- شیمی تجزیه در کنکور ارشد سالهای اخیر
- پاسخ تشریحی سوالات کنکور کارشناسی ارشد96- درس شیمی تجزیه
- پاسخ سوالات شیمی کنکور سراسری ریاضی 96
نویسندگان
بایگانی
- دی 1402 1
- اردیبهشت 1402 1
- دی 1401 1
- آبان 1401 1
- آبان 1398 2
- مرداد 1398 1
- مهر 1397 2
- تیر 1397 1
- اردیبهشت 1397 2
- آذر 1396 2
- تیر 1396 3
- اردیبهشت 1396 2
- فروردین 1396 2
- اسفند 1395 4
- دی 1395 1
- آذر 1395 2
- آبان 1395 3
- مهر 1395 2
- اسفند 1394 1
- بهمن 1394 1
- دی 1394 1
- آذر 1394 4
- آبان 1394 1
- مهر 1394 3
- شهریور 1394 5
- مرداد 1394 4
- تیر 1394 2
- خرداد 1394 5
- اردیبهشت 1394 15
- فروردین 1394 7
- اسفند 1393 7
- بهمن 1393 4
- دی 1393 12
- آذر 1393 14
- آبان 1393 7
- مهر 1393 16
- شهریور 1393 7
- مرداد 1393 2
- تیر 1393 4
- خرداد 1393 18
- اردیبهشت 1393 14
- فروردین 1393 2
- اسفند 1392 8
- بهمن 1392 4
- دی 1392 16
- آذر 1392 7
- آبان 1392 9
- مهر 1392 15
- شهریور 1392 12
- مرداد 1392 9
- تیر 1392 9
- خرداد 1392 28
- اردیبهشت 1392 33
- فروردین 1392 2
- اسفند 1391 23
- بهمن 1391 2
- دی 1391 4
تقویم
دی 1402| ش | ی | د | س | چ | پ | ج |
| 1 | ||||||
| 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 23 | 24 | 25 | 26 | 27 | 28 | 29 |
| 30 |
جستجو
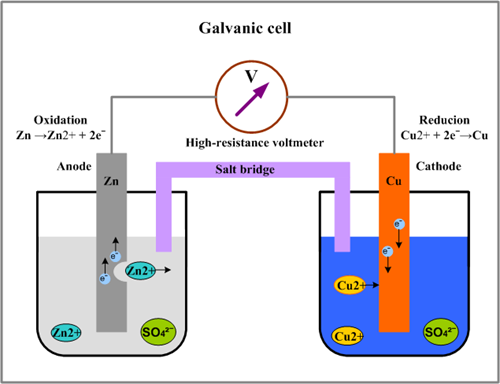
بیایید برق تولید کنیم!
تجسم کنید در آزمایشگاه شیمی هستید و مشغول انجام آزمایشی هستید. که ناگهان برق می رود! فرض کنیم که هیچ وسیله ی روشنایی ( برق اضطراری _ شمع _ چراغ قوه _ و حتی دریغ از یک کبریت !) ندارید. حال می خواهید خودتان به کمک مواد شیمیایی موجود در آزمایشگاه ، لامپی را روشن کنید.مسلما باید یک سلول الکترو شیمیایی گالوانی بسازید.
یک سلول الکترو شیمیایی گالوانی شامل دو نیم سلول است .به عنوان مثال سلول الکترو شیمیایی گالوانی (Zn_Cu) از دو نیم سلول زیر تشکیل شده است.
نیم سلول روی(Zn) : شامل تیغه ای از فلز روی است که در محلولی از روی سولفات یک مولار قرار دارد.
نیم سلول مس (Cu): شامل تیغه ای از فلز مس است که در محلولی از مس (II) سولفات یک مولار قرار دارد.
اگر دو نیم سلول فوق را به یکدیگر متصل کنید و یک پل نمکی را به عنوان رابط بین آن ها قرار دهید، مشاهده خواهید کرد که لامپی که در این مدار الکتریکی قرار می گیرد روشن می شود.
حال این سوال مطرح می شود که این دستگاه چگونه برق تولید می کند؟
برای بررسی نحوه ی کار کردن این دستگاه ، بگذارید وضعیت هر یک از نیم سلول را بررسی کنیم.
پتانسیل الکتریکی روی که برابر است با (0.76_ ) ولت و پتانسیل الکتریکی مس برابر است با (0.34 +) ولت .

سلام



دستم درد نمیکنه!! اصلا چرا دستا باید درد بکنه!!؟؟
خوبی از خودتونه
دست گلت درد نکنه آشنای عزیزم که زود سایز عکس ها رو درست کردی،چقد تو خوبی
ای شیطون، به اینش دیگه فکر نکرده بودم،آره همون صفحه گوشی خوبه، بعضی ها هم که گوشیشون چراغ قوه داره ،اون دیگه عالیه
سلام

چه جالب فقط یه سوال؛ تو اون تاریکی چطوری اینارو ببینیم تا بخوایم این کارارو انجام بدیم؟؟
با نور صفحه گوشی